El etanol es un alcohol primario. Alcoholes: concepto, propiedades, aplicación.
Junto con los hidrocarburos C A norte V, que contienen dos tipos de átomos: C y H, se conocen compuestos orgánicos de tipo C que contienen oxígeno A norte V ACERCA DE Con. En el Tema 2 veremos compuestos que contienen oxígeno que se diferencian:
1) el número de átomos de O en la molécula (uno, dos o más);
2) la multiplicidad del enlace carbono-oxígeno (C-O simple o C=O doble);
3) el tipo de átomos conectados al oxígeno (C–O–H y C–O–C).
Lección 16.
Alcoholes saturados monohídricos
Los alcoholes son derivados de hidrocarburos de fórmula general ROH, donde R es un radical hidrocarbonado. La fórmula de un alcohol se obtiene a partir de la fórmula del alcano correspondiente sustituyendo el átomo de H por un grupo OH: RH ROH.
La fórmula química de los alcoholes se puede derivar de diferentes maneras, incluido el átomo de oxígeno O entre los átomos.
C – H de una molécula de hidrocarburo:
RH ROH, CH 3 –H CH 3 –O–H.
El grupo hidroxilo OH es grupo funcional alcohol. Es decir, el grupo OH es una característica de los alcoholes, determina las principales propiedades físicas y químicas de estos compuestos.
La fórmula general de los alcoholes saturados monohídricos es C. norte H2 norte+1OH.
nombres de alcoholes obtenido de los nombres de hidrocarburos con el mismo número de átomos de C que en el alcohol agregando el sufijo - viejo-. Por ejemplo:
![]()
El nombre alcoholes como derivados de los alcanos correspondientes es característico de compuestos de cadena lineal. La posición del grupo OH en ellos es en el átomo exterior o interior.
C – indicado con un número después del nombre:
Los nombres de los alcoholes, derivados de hidrocarburos ramificados, se compilan de la forma habitual. Seleccione la cadena de carbono principal, que debe incluir un átomo de C conectado a un grupo OH. Los átomos de C de la cadena principal están numerados de manera que el carbono con el grupo OH recibe un número menor:

El nombre se compila comenzando con un número que indica la posición del sustituyente en la cadena carbonada principal: “3-metil...” Luego se nombra la cadena principal: “3-metilbutano...” Finalmente, el sufijo es agregado - viejo-(nombre del grupo OH) y el número indica el átomo de carbono al que está unido el grupo OH: “3-metilbutanol-2”.
Si hay varios sustituyentes en la cadena principal, se enumeran secuencialmente, indicando la posición de cada uno con un número. Los sustituyentes repetidos en el nombre se escriben utilizando los prefijos "di-", "tri-", "tetra-", etc. Por ejemplo:

Isomería de alcoholes. Los isómeros de alcohol tienen la misma fórmula molecular, pero un orden diferente de conexión de átomos en las moléculas.
Dos tipos de isomería de alcoholes:
1) isomería del esqueleto de carbono;
2)isomería de la posición del grupo hidroxilo en la molécula.
Presentemos los isómeros de alcohol C 5 H 11 OH de estos dos tipos en notación lineal-angular:

Según el número de átomos de C unidos al carbono del alcohol (–C–OH), es decir Los alcoholes vecinos se llaman primario(un vecino C), secundario(dos C) y terciario(tres sustituyentes C en el carbono –C –OH). Por ejemplo:

Tarea. Forma un isómero de alcoholes con la fórmula molecular. C6H13OH con una cadena de carbono principal:
a) C 6, b) C 5, V) C 4, GRAMO) C 3
y nombrarlos.
Solución
1) Anotamos las principales cadenas de carbonos con un número determinado de átomos de C, dejando espacio para los átomos de H (las indicaremos más adelante):
a) С–С–С–С–С–С; b) С–С–С–С–С; c) S–S–S–S; d) S–S–S.
2) Seleccionamos arbitrariamente el lugar de unión del grupo OH a la cadena principal e indicamos sustituyentes de carbono en los átomos de C internos:
En el ejemplo d) no es posible colocar tres sustituyentes CH3 en el átomo C-2 de la cadena principal. El alcohol C 6 H 13 OH no tiene isómeros con una cadena principal de tres carbonos.
3) Ordenamos los átomos de H en los carbonos de la cadena principal de isómeros a)–c), guiándonos por la valencia del carbono C(IV), y nombramos los compuestos:
EJERCICIOS.
1. Subraye las fórmulas químicas de los alcoholes monohídricos saturados:
CH 3 OH, C 2 H 5 OH, CH 2 = CH CH 2 OH, CH CH 2 OH, C 3 H 7 OH,
CH3CHO, C6H5CH2OH, C4H9OH, C2H5OC2H5, HOCH2CH2OH.
2. Nombra los siguientes alcoholes:

3.
Inventa fórmulas estructurales basadas en los nombres de los alcoholes: a) hexanol-3;
b) 2-metilpentanol-2; c) n-octanol; d) 1-fenilpropanol-1; e) 1-ciclohexiletanol.
4.
Componga las fórmulas estructurales de los isómeros de alcoholes con la fórmula general. C6H13OH :
un primario; b) secundaria; c) terciario.Nombra estos alcoholes.
5. Utilizando las fórmulas lineal-angulares (gráficas) de los compuestos, escriba sus fórmulas estructurales y dé nombres a las sustancias:
Lección 17. Preparación de alcoholes
Los alcoholes de bajo peso molecular (metanol CH 3 OH, etanol C 2 H 5 OH, propanol C 3 H 7 OH e isopropanol (CH 3) 2 CHOH) son líquidos móviles incoloros con un olor alcohólico específico. Puntos de ebullición altos: 64,7 °C – CH 3 OH, 78 °C – C 2 H 5 OH, 97 °C – norte-C 3 H 7 OH y 82 °C – (CH 3) 2 CHOH – se deben a intermoleculares enlace de hidrógeno, existente en los alcoholes. Los alcoholes C (1) – C (3) se mezclan con agua (se disuelven) en cualquier proporción. Estos alcoholes, especialmente el metanol y el etanol, son los más utilizados en la industria.
1. Metanol sintetizado a partir de gas agua:

2. Etanol conseguir hidratación de etileno(agregando agua a C 2 H 4):
3. Otra forma de recibir etanol – fermentación de sustancias azucaradas bajo la acción de enzimas de levadura. El proceso de fermentación alcohólica de la glucosa (azúcar de uva) tiene la forma:
4. Etanol conseguir de almidón, y hecho de madera(celulosa) por hidrólisis a la glucosa y fermentación posterior en alcohol:
5. Alcoholes superiores conseguir a partir de hidrocarburos halogenados por hidrólisis bajo la influencia de soluciones acuosas de álcalis:
Tarea.¿Cómo obtener 1-propanol a partir de propano?
Solución
De los cinco métodos de producción de alcoholes propuestos anteriormente, ninguno considera la producción de alcohol a partir de un alcano (propano, etc.). Por tanto, la síntesis de 1-propanol a partir de propano incluirá varias etapas. Según el método 2 se obtienen alcoholes a partir de alquenos, que a su vez se obtienen mediante deshidrogenación de alcanos. El diagrama del proceso es el siguiente:
Otro esquema para la misma síntesis es un paso más largo, pero es más fácil de implementar en el laboratorio:
La adición de agua al propeno en la última etapa se realiza según la regla de Markovnikov y conduce a un alcohol secundario: propanol-2. La tarea requiere que obtengas 1-propanol. Por tanto, el problema no está solucionado, buscamos otro camino.
El método 5 consiste en la hidrólisis de haloalcanos. El intermedio necesario para la síntesis de 1-propanol, el 1-cloropropano, se obtiene de la siguiente manera. La cloración del propano da una mezcla de 1 y 2 monocloropropanos:

De esta mezcla se aísla 1-cloropropano (por ejemplo, mediante cromatografía de gases o debido a diferentes puntos de ebullición: para 1-cloropropano t kip = 47 °C, para 2-cloropropano t kip = 36 °C). Al tratar el 1-cloropropano con KOH o NaOH alcalino acuoso, se sintetiza el propanol-1 objetivo:
Tenga en cuenta que la interacción de las mismas sustancias: CH 3 CH 2 CH 2 Cl y KOH - dependiendo del disolvente (alcohol C 2 H 5 OH o agua) da lugar a diferentes productos - propileno
(en alcohol) o propanol-1 (en agua).
EJERCICIOS.
1. Proporcione ecuaciones de reacción para la síntesis industrial de metanol a partir de agua gaseosa y etanol mediante hidratación de etileno.
2. alcoholes primarios RCH2OH preparado por hidrólisis de haluros de alquilo primarios RCH 2 Hal, y los alcoholes secundarios se sintetizan por hidratación de alquenos. Completa las ecuaciones de reacción:

3.
Sugerir métodos para producir alcoholes: a) butanol-1; b) butanol-2;
c) pentanol-3, a partir de alquenos y haluros de alquilo.
4. Durante la fermentación enzimática de azúcares, junto con el etanol, se forma una mezcla de alcoholes primarios en pequeñas cantidades. C 3 – C 5 – aceite de fusel. El componente principal de esta mezcla es el isopentanol.(CH3)2CHCH2CH2OH, componentes menores – norte-C3H7OH, (CH3)2CHCH2OH y CH3CH2CH(CH3)CH2OH. Nombra estos Alcoholes “fusel” según la nomenclatura IUPAC. Escribe una ecuación para la reacción de fermentación de la glucosa. C6H12O6, en el que los cuatro alcoholes de impureza se obtendrían en una relación molar de 2:1:1:1, respectivamente. Introduzca gas CO2 al lado derecho de la ecuación en la cantidad de 1/3 mol de todos los átomos iniciales CON , así como el número requerido de moléculas. H2O.
5.
Dar las fórmulas de todos los alcoholes aromáticos de la composición. C8H10O. (En alcoholes aromáticos el grupoÉL eliminado del anillo de benceno por uno o más átomos CON:
C6H5 –
(CH2)n –
ÉL.)
Respuestas a los ejercicios del tema 2.
Lección 16
1. Las fórmulas químicas de los alcoholes monohídricos saturados están subrayadas:
capítulo 3 ÉL, CON 2 norte 5 ÉL, CH2 = CHCH2OH, CHCH2OH, CON 3 norte 7 ÉL,
CH3CHO, C6H5CH2OH, CON 4 norte 9 ÉL, C2H5OS2H5, HOCH2CH2OH.
2. Nombres de alcoholes por fórmulas estructurales:

3. Fórmulas estructurales por nombres de alcohol:
4. Isómeros y nombres de alcoholes de fórmula general C 6 H 13 OH:

5. Fórmulas estructurales y nombres compilados a partir de diagramas gráficos de conexión:
(alcoholes) una clase de compuestos orgánicos que contienen uno o más grupos COH, con el grupo hidroxilo OH unido a un átomo de carbono alifático (los compuestos en los que el átomo de carbono del grupo COH forma parte del anillo aromático se denominan fenoles)La clasificación de los alcoholes es variada y depende de qué característica estructural se toma como base.
1. Dependiendo de la cantidad de grupos hidroxilo en la molécula, los alcoholes se dividen en:
a) monoatómico (contiene un grupo hidroxilo OH), por ejemplo, metanol CH 3 OH, etanol C 2 H 5 OH, propanol C 3 H 7 OH
b) poliatómico (dos o más grupos hidroxilo), por ejemplo, etilenglicol
HO С H 2 CH 2 OH , glicerol HOCH 2 CH(OH)CH 2 OH, pentaeritritol C(CH 2 OH) 4.Compuestos en los que un átomo de carbono
Existen dos grupos hidroxilo, en la mayoría de los casos son inestables y se convierten fácilmente en aldehídos, eliminando agua: RCH (OH) 2 ® RCH = O + H 2 O , no existe.2. Según el tipo de átomo de carbono al que está unido el grupo OH, los alcoholes se dividen en:
a) primario, en el que el grupo OH está unido al átomo de carbono primario. Un átomo de carbono (resaltado en rojo) que está unido a un solo átomo de carbono se llama primario. Ejemplos de alcoholes primarios etanol C
H3CH2OH, propanol CH3CH2CH2OH. b) secundario, en el que el grupo OH está unido a un átomo de carbono secundario. Un átomo de carbono secundario (resaltado en azul) está unido a dos átomos de carbono al mismo tiempo, por ejemplo, propanol secundario, butanol secundario (Fig. 1).
Arroz. 1. ESTRUCTURA DE LOS ALCOHOLES SECUNDARIOS
c) terciario, en el que el grupo OH está unido al átomo de carbono terciario. El átomo de carbono terciario (resaltado en verde) está unido a tres átomos de carbono vecinos simultáneamente, por ejemplo, butanol terciario y pentanol (Figura 2).

Arroz. 2. ESTRUCTURA DE LOS ALCOHOLES TERCIARIOS
Según el tipo de átomo de carbono, el grupo alcohol unido a él también se denomina primario, secundario o terciario.
En los alcoholes polihídricos que contienen dos o más grupos OH, tanto los grupos HO primarios como los secundarios pueden estar presentes simultáneamente, por ejemplo, en glicerol o xilitol (Fig. 3).

Arroz. 3. COMBINACIÓN DE GRUPOS OH PRIMARIO Y SECUNDARIO EN LA ESTRUCTURA DE ALCOHOLES POLIATÓMICOS.
3. Según la estructura de los grupos orgánicos conectados por un grupo OH, los alcoholes se dividen en saturados (metanol, etanol, propanol), insaturados, por ejemplo, alcohol alílico CH 2 = CHCH 2 OH, aromáticos (por ejemplo, alcohol bencílico C 6 H 5 CH 2 OH), que contiene como parte del grupo
R grupo aromático.Alcoholes insaturados en los que el grupo OH es "adyacente" al doble enlace, es decir unidos a un átomo de carbono involucrado simultáneamente en la formación de un doble enlace (por ejemplo, alcohol vinílico CH 2 =CHOH), son extremadamente inestables y se isomerizan inmediatamente ( cm.ISOMERIZACIÓN) en aldehídos o cetonas:
CH 2 =CHOH ® CH 3 CH=O Nomenclatura de alcoholes. Para los alcoholes comunes con una estructura simple, se utiliza una nomenclatura simplificada: el nombre del grupo orgánico se convierte en un adjetivo (usando el sufijo y la terminación “ nuevo") y añadir la palabra "alcohol":En el caso de que la estructura de un grupo orgánico sea más compleja, se utilizan reglas comunes a toda la química orgánica. Los nombres compilados de acuerdo con tales reglas se denominan sistemáticos. De acuerdo con estas reglas, la cadena de hidrocarburos se numera desde el extremo al que se encuentra el grupo OH más cercano. A continuación, esta numeración se utiliza para indicar la posición de varios sustituyentes a lo largo de la cadena principal, al final del nombre se añade el sufijo “ol” y un número que indica la posición del grupo OH (Fig.4): 4. NOMBRES SISTEMÁTICOS DE ALCOHOLES. Los grupos funcionales (OH) y sustituyentes (CH 3), así como sus correspondientes índices digitales, están resaltados en diferentes colores.Los nombres sistemáticos de los alcoholes más simples siguen las mismas reglas: metanol, etanol, butanol. Para algunos alcoholes, se han conservado nombres triviales (simplificados) que se desarrollaron históricamente: alcohol propargílico NSє
CCH 2 OH, glicerol HOCH 2 CH(OH)CH 2 OH, pentaeritritol C(CH 2 OH) 4, alcohol fenetílico C 6 H 5 CH 2 CH 2 OH.Propiedades físicas de los alcoholes.
Los alcoholes son solubles en la mayoría de los disolventes orgánicos; los primeros tres representantes más simples: metanol, etanol y propanol, así como butanol terciario (H 3 C) 3 СОН se mezclan con agua en cualquier proporción. Con un aumento en el número de átomos de C en un grupo orgánico, el efecto hidrofóbico (repelente al agua) comienza a afectar, la solubilidad en agua se vuelve limitada y cuando R que contiene más de 9 átomos de carbono prácticamente desaparece.
4. NOMBRES SISTEMÁTICOS DE ALCOHOLES. Los grupos funcionales (OH) y sustituyentes (CH 3), así como sus correspondientes índices digitales, están resaltados en diferentes colores.Los nombres sistemáticos de los alcoholes más simples siguen las mismas reglas: metanol, etanol, butanol. Para algunos alcoholes, se han conservado nombres triviales (simplificados) que se desarrollaron históricamente: alcohol propargílico NSє
CCH 2 OH, glicerol HOCH 2 CH(OH)CH 2 OH, pentaeritritol C(CH 2 OH) 4, alcohol fenetílico C 6 H 5 CH 2 CH 2 OH.Propiedades físicas de los alcoholes.
Los alcoholes son solubles en la mayoría de los disolventes orgánicos; los primeros tres representantes más simples: metanol, etanol y propanol, así como butanol terciario (H 3 C) 3 СОН se mezclan con agua en cualquier proporción. Con un aumento en el número de átomos de C en un grupo orgánico, el efecto hidrofóbico (repelente al agua) comienza a afectar, la solubilidad en agua se vuelve limitada y cuando R que contiene más de 9 átomos de carbono prácticamente desaparece. Debido a la presencia de grupos OH, surgen enlaces de hidrógeno entre las moléculas de alcohol.
Arroz. 5. ENLACES DE HIDRÓGENO EN ALCOHOLES(mostrado en línea de puntos)
Como resultado, todos los alcoholes tienen un punto de ebullición más alto que los hidrocarburos correspondientes, por ejemplo, p.e. etanol +78°C y T. hervir. etano 88,63°C; T. kip. butanol y butano, respectivamente, +117,4° C y 0,5° C.
Propiedades químicas de los alcoholes. Los alcoholes tienen una variedad de transformaciones. Las reacciones de los alcoholes tienen algunos principios generales: la reactividad de los alcoholes monohídricos primarios es mayor que la de los secundarios, a su vez, los alcoholes secundarios son químicamente más activos que los terciarios. Para los alcoholes dihídricos, en el caso de que los grupos OH estén ubicados en átomos de carbono vecinos, se observa una mayor reactividad (en comparación con los alcoholes monohídricos) debido a la influencia mutua de estos grupos. Para los alcoholes, son posibles reacciones que implican la ruptura de enlaces CO y OH.1. Reacciones que ocurren a través del enlace OH.
Al interactuar con metales activos (Na, K, Mg, Al), los alcoholes exhiben las propiedades de los ácidos débiles y forman sales llamadas alcoholatos o alcóxidos:
CH 3 OH + 2 Na ® 2 CH 3 OK + H 2Los alcoholatos son químicamente inestables y, cuando se exponen al agua, se hidrolizan para formar alcohol e hidróxido metálico:
C2H5OK + H2O
® C2H5OH + KOHEsta reacción muestra que los alcoholes son ácidos más débiles en comparación con el agua (un ácido fuerte desplaza a uno débil), además, al interactuar con soluciones alcalinas, los alcoholes no forman alcoholatos. Sin embargo, en los alcoholes polihídricos (en el caso de que los grupos OH estén unidos a átomos de C vecinos), la acidez de los grupos alcohol es mucho mayor y pueden formar alcoholatos no solo cuando interactúan con metales, sino también con álcalis:
HOCH2CH2OH + 2NaOH® NaOCH2CH2ONa + 2H2OCuando los grupos HO en alcoholes polihídricos están unidos a átomos de C no adyacentes, las propiedades de los alcoholes son cercanas a las monoatómicas, ya que no aparece la influencia mutua de los grupos HO.Al interactuar con ácidos minerales u orgánicos, los alcoholes forman compuestos ésteres que contienen un fragmento.
ROA (Un residuo ácido). La formación de ésteres también ocurre durante la interacción de alcoholes con anhídridos y cloruros de ácido. ácidos carboxílicos(Figura 6).Bajo la acción de agentes oxidantes (K 2 Cr 2 O 7, KMnO 4), los alcoholes primarios forman aldehídos y los alcoholes secundarios, cetonas (Fig.7).

Arroz. 7. FORMACIÓN DE ALDEHÍDOS Y CETONAS DURANTE LA OXIDACIÓN DE ALCOHOLES
La reducción de alcoholes conduce a la formación de hidrocarburos que contienen el mismo número de átomos de C que la molécula del alcohol original (Fig. 8).
 8. RESTAURACIÓN DE BUTANOL
8. RESTAURACIÓN DE BUTANOL2. Reacciones que ocurren a través del enlace CO.
En presencia de catalizadores o ácidos minerales fuertes, se produce la deshidratación de los alcoholes (eliminación de agua) y la reacción puede desarrollarse en dos direcciones:
a) deshidratación intermolecular que involucra dos moléculas de alcohol, en la que los enlaces de CO en una de las moléculas se rompen, como resultado de lo cual se forman éteres, compuestos que contienen un fragmento
R О R (Figura 9A).b) la deshidratación intramolecular produce alquenos, hidrocarburos con un doble enlace. A menudo, ambos procesos, la formación de un éter y un alqueno, ocurren en paralelo (Fig. 9B).
En el caso de los alcoholes secundarios, durante la formación de un alqueno, son posibles dos direcciones de reacción (Fig. 9B), la dirección predominante es aquella en la que, durante el proceso de condensación, el hidrógeno se separa del átomo de carbono menos hidrogenado (marcado por el número 3), es decir rodeado por menos átomos de hidrógeno (en comparación con el átomo 1). Mostrado en la Fig. Se utilizan 10 reacciones para producir alquenos y éteres.
La ruptura del enlace CO en los alcoholes también se produce cuando el grupo OH se reemplaza por un grupo halógeno o amino (Fig. 10).

Arroz. 10. SUSTITUCIÓN DEL GRUPO OH EN ALCOHOLES POR GRUPO HALÓGENO O AMINO
Las reacciones mostradas en la Fig. 10 se utiliza para la producción de halocarbonos y aminas.
Preparación de alcoholes. Algunas de las reacciones que se muestran arriba (Fig. 6,9,10) son reversibles y, cuando las condiciones cambian, pueden proceder en la dirección opuesta, lo que lleva a la producción de alcoholes, por ejemplo, durante la hidrólisis de ésteres y halocarbonos (Fig. 11A y B, respectivamente), así como por hidratación de alquenos mediante la adición de agua (Fig. 11B).
Arroz. once. OBTENCIÓN DE ALCOHOLES POR HIDRÓLISIS E HIDRATACIÓN DE COMPUESTOS ORGÁNICOS
La reacción de hidrólisis de alquenos (Fig. 11, Esquema B) es la base de la producción industrial de alcoholes inferiores que contienen hasta 4 átomos de C.
El etanol también se forma durante la llamada fermentación alcohólica de azúcares, por ejemplo, glucosa C 6 H 12 O 6. El proceso se produce en presencia de levadura y conduce a la formación de etanol y CO 2:
® 2C 2 H 5 OH + 2CO 2La fermentación no puede producir más de un 15% de solución acuosa de alcohol, ya que a mayor concentración de alcohol los hongos de levadura mueren. Las soluciones alcohólicas de mayor concentración se obtienen por destilación.
El metanol se produce industrialmente mediante la reducción del monóxido de carbono a 400
° C bajo una presión de 2030 MPa en presencia de un catalizador compuesto por óxidos de cobre, cromo y aluminio:® H 3 HIJO Si en lugar de hidrólisis de alquenos (Fig.11) se lleva a cabo oxidación, se forman alcoholes dihídricos (Fig.12). 12.
PREPARACIÓN DE ALCOHOLES DIOHÓMICOSUso de alcoholes.
La capacidad de los alcoholes para participar en una variedad de reacciones químicas permite su uso para producir todo tipo de compuestos orgánicos: aldehídos, cetonas, ácidos carboxílicos, éteres y ésteres, utilizados como disolventes orgánicos en la producción de polímeros, colorantes y fármacos.
12.
PREPARACIÓN DE ALCOHOLES DIOHÓMICOSUso de alcoholes.
La capacidad de los alcoholes para participar en una variedad de reacciones químicas permite su uso para producir todo tipo de compuestos orgánicos: aldehídos, cetonas, ácidos carboxílicos, éteres y ésteres, utilizados como disolventes orgánicos en la producción de polímeros, colorantes y fármacos. El metanol CH 3 OH se utiliza como disolvente, así como en la producción de formaldehído, utilizado para producir resinas de fenol-formaldehído; recientemente el metanol se ha considerado como un combustible de motor prometedor. Se utilizan grandes volúmenes de metanol en la producción y transporte de gas natural. Metanol, el compuesto más tóxico entre todos los alcoholes, dosis letal cuando se toma por vía oral 100 ml.
Etanol C 2 H 5 OH el compuesto de partida para la producción de acetaldehído, ácido acético, así como para la producción de ésteres de ácidos carboxílicos utilizados como disolventes. Además, el etanol es el componente principal de todas las bebidas alcohólicas y se utiliza ampliamente en medicina como desinfectante.
El butanol se utiliza como disolvente de grasas y resinas, además, sirve como materia prima para la producción de sustancias aromáticas (acetato de butilo, salicilato de butilo, etc.). En champús se utiliza como componente que aumenta la transparencia de las soluciones.
El alcohol bencílico C 6 H 5 CH 2 OH en estado libre (y en forma de ésteres) se encuentra en los aceites esenciales de jazmín y jacinto. Tiene propiedades antisépticas (desinfectantes), en cosmética se utiliza como conservante de cremas, lociones, elixires dentales y en perfumería como sustancia fragante.
El alcohol fenetílico C 6 H 5 CH 2 CH 2 OH tiene aroma a rosas, se encuentra en el aceite de rosas y se utiliza en perfumería.
El etilenglicol HOCH 2 CH 2 OH se utiliza en la producción de plásticos y como anticongelante (aditivo que reduce el punto de congelación de soluciones acuosas), además, en la fabricación de tintas textiles y de imprenta.
El dietilenglicol HOCH 2 CH 2 OCH 2 CH 2 OH se utiliza para rellenar dispositivos de frenos hidráulicos, así como en la industria textil para el acabado y teñido de tejidos.
Glicerol
HOCH2CH(OH)CH2OH Se utiliza para producir resinas de poliéster gloftálico y es un componente de muchas preparaciones cosméticas. La nitroglicerina (Fig. 6) es el componente principal de la dinamita y se utiliza como explosivo en la minería y la construcción de ferrocarriles.Pentaeritritol (
HOCH 2) El 4 C se utiliza para producir poliésteres (resinas pentaftálicas), como endurecedor de resinas sintéticas, como plastificante para cloruro de polivinilo y también en la producción del explosivo tetranitropentaeritritol.Los alcoholes polihídricos xilitol HOCH 2 (CHOH) 3 CH 2 OH y sorbitol neHOCH 2 (CHOH) 4 CH 2 OH tienen un sabor dulce, se utilizan en lugar del azúcar en la elaboración de productos de confitería para pacientes con diabetes y personas con obesidad. El sorbitol se encuentra en las bayas de serbal y cereza.
Mijaíl Levitski
LITERATURA Shabarov Yu.S. Química Orgánica. Moscú, “Química”, 1994Propiedades químicas de los alcoholes saturados monohídricos.
I. Reacciones de sustitución
1. Sustitución de átomos de hidrógeno del grupo hidroxilo debido a la escisión del enlace O-H
La velocidad de las reacciones en las que se rompe el enlace O-H disminuye en la serie: alcoholes primarios → secundarios → terciarios.
a) Interacción con metales activos para formar alkagolatos metálicos (alcanolatos):
2C 2 H 5 −OH + 2Na → C 2 H 5 −ONa + H 2
alcoholatos Son similares a las sales de un ácido muy débil y además se hidrolizan fácilmente. Los alcoholatos son extremadamente inestables y, cuando se exponen al agua, se descomponen en alcohol y álcali. Esto demuestra que los alcoholes son ácidos más débiles que el agua. ¡De esto se deduce que los alcoholes monohídricos no reaccionan con los álcalis!
C 2 H 5 −ONa + HOH → C 2 H 5 −OH + NaOH
b) Interacción con ácidos orgánicos e inorgánicos para formar ésteres ( reacción de esterificación)
C 2 H 5 −OH + HO −NO 2 ↔ C 2 H 5 −O −NO 2 + HOH
Éster etílico del ácido nítrico
CH 3 −COOH + HO −C 2 H 5 ↔ CH 3 COO −C 2 H 5 + HOH
Ácido etilacético
2. Sustitución del grupo hidroxilo debido a la ruptura del enlace C-O
a) Las soluciones de alcohol tienen una reacción neutra a los indicadores.
b) Reacción con amoníaco para formar aminas primarias (y con un exceso de alcohol, los radicales alquilo pueden sustituir 2 o 3 átomos de hidrógeno en NH3 y formar aminas secundarias y terciarias)
C 2 H 5 −OH + H − NH 2 → C 2 H 5 − NH 2 + H − OH.
etilamina
C 2 H 5 −OH + H − NH − C 2 H 5 → NH − (C 2 H 5) 2 + H − OH.
dietilamina
c) Reacción con haluros de hidrógeno para formar haloalcanos
C2H5-OH + HCl → C2H5-Cl + HOH.
d) Reacción con cloruro de tionilo para formar haloalcanos
C 4 H 9 −OH + SO 2 Cl 2 → C 4 H 9 −Cl + HCl + SO 2 .
e) Reacción con cloruro de fósforo para formar haloalcanos
C 4 H 9 −OH + PCl 5 → C 4 H 9 −Cl + POCl 3 + HCl.
II. Reacciones de eliminación
1. Reacción de deshidratación, es decir. dividir una molécula de agua
a) Deshidratación intermolecular de alcoholes con formación de éteres R−O−R"
C2H5-OH + HO-C2H5 → C2H5-O- C2H5 + H-OH.
Éter dietílico
b) Deshidratación intramolecular de alcoholes con formación de alquenos.
H-CH2-CH2-OH → CH2 =CH2 + H-OH.
2. Reacción de deshidrogenación (rotura de enlaces O – H y C – H)
a) Cuando los alcoholes primarios se deshidrogenan, se forman aldehídos.
CH3 −CH−O−H → CH3 −CH=O + H2
b) Cuando los alcoholes secundarios se deshidrogenan, se forman cetonas.
CH3 −C−CH3 → CH3 −C−CH3 + H2
c) Los alcoholes terciarios no se deshidrogenan
III. Reacciones de oxidación
a) Combustión (oxidación completa) de alcoholes.
C 2 H 5 OH + 3O 2 → 2CO 2 + 3H 2 O +Q.
Cuando se queman, se libera mucho calor, que a menudo se utiliza en los laboratorios (quemadores de laboratorio). Los alcoholes inferiores arden con una llama casi incolora, mientras que los alcoholes superiores tienen una llama amarillenta debido a la combustión incompleta del carbono.
b) Oxidación incompleta de alcoholes con oxígeno atmosférico con formación de aldehídos o con oxidación adicional de ácido carboxílico (de alcoholes primarios) y cetonas (de alcoholes secundarios)
2CH3OH + O2 → 2HCH=O + 2H2O,
CH 3 −CH 2 OH + O 2 → CH 3 −COOH + H 2 O,
2CH3 −CH(OH)−CH3 + O 2 → 2CH3 −C(=O)−CH3 + 2H2O.
c) Oxidación incompleta de alcoholes con oxígeno oxidante en presencia de un catalizador con formación de aldehídos o con oxidación adicional de ácido carboxílico (de alcoholes primarios) y cetonas (de alcoholes secundarios)
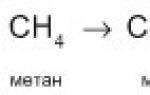
CH4 + [O] → HCH=O + H2O,
CH3 −CH2OH + 2[O] → CH3 −COOH + H2O,
CH3 −CH(OH)−CH3 + [O] → CH3 −C(=O)−CH3 + H2O.
Propiedades químicas de los alcoholes saturados polihídricos.
Propiedades químicas de los alcoholes polihídricos. lo mismo que alcoholes monohídricos, pero la diferencia es que la reacción no avanza uno a la vez hasta el grupo hidroxilo, sino varios a la vez. Una de las principales diferencias es alcoholes polihídricos reacciona fácilmente con una solución recién preparada de hidróxido de cobre (II) (precipitado azul). Esto produce una solución transparente de una sal de cobre compleja de un color azul violeta brillante. Es esta reacción la que puede detectar la presencia de un alcohol polihídrico en cualquier solución.
Uso de alcoholes.
La capacidad de los alcoholes para participar en una variedad de reacciones químicas permite su uso para producir todo tipo de compuestos orgánicos: aldehídos, cetonas, ácidos carboxílicos, éteres y ésteres, utilizados como disolventes orgánicos en la producción de polímeros, colorantes y fármacos.
Metanol CH3OH se utiliza como disolvente, así como en la producción de formaldehído, utilizado para producir resinas de fenol-formaldehído; recientemente el metanol se ha considerado como un combustible de motor prometedor. Se utilizan grandes volúmenes de metanol en la producción y transporte de gas natural. El metanol es el compuesto más tóxico entre todos los alcoholes, la dosis letal cuando se ingiere es de 100 ml.
Etanol C 2 H 5 OH– el compuesto de partida para la producción de acetaldehído, ácido acético, así como para la producción de ésteres de ácidos carboxílicos utilizados como disolventes, medicamentos, perfumes y colonias, cauchos, combustible para motores, tintes, barnices, disolventes y otras sustancias. Además, el etanol es el componente principal de todas las bebidas alcohólicas y se utiliza ampliamente en medicina como desinfectante.
butanol Se utiliza como disolvente de grasas y resinas, además, sirve como materia prima para la producción de sustancias fragantes (acetato de butilo, salicilato de butilo, etc.). En champús se utiliza como componente que aumenta la transparencia de las soluciones.
Alcohol bencílico C 6 H 5 –CH 2 –OH en estado libre (y en forma de ésteres) se encuentra en los aceites esenciales de jazmín y jacinto. Tiene propiedades antisépticas (desinfectantes), en cosmética se utiliza como conservante de cremas, lociones, elixires dentales y en perfumería como sustancia fragante.
Alcohol fenetílico C 6 H 5 –CH 2 –CH 2 –OH Tiene aroma a rosas, se encuentra en el aceite de rosas y se utiliza en perfumería.
Etilenglicol HOCH 2 –CH 2 OH utilizado en la producción de plásticos y como anticongelante (aditivo que reduce el punto de congelación de soluciones acuosas), además, en la fabricación de tintas textiles y de impresión. dinitroetilenglicol utilizado como explosivos
Dietilenglicol HOCH 2 –CH 2 OCH 2 –CH 2 OH Se utiliza para el llenado de dispositivos hidráulicos de frenos, así como en la industria textil para el acabado y teñido de tejidos.
Glicerol HOCH 2 –CH(OH)–CH 2 OH Se utiliza para producir resinas de poliéster gloftálico; además, es un componente de muchas preparaciones cosméticas como conservante y como medio para prevenir la congelación y la desecación. Nitroglicerina utilizado como explosivo - como componente principal de la dinamita, utilizado en la minería y la construcción de ferrocarriles como explosivo. trinitroglicerina− también en medicina, como vasodilatador.
Pentaeritritol (HOCH 2) 4 C Se utiliza para producir poliésteres (resinas pentaftálicas), como endurecedor de resinas sintéticas, como plastificante para cloruro de polivinilo y también en la producción del explosivo tetranitropentaeritritol.
Alcoholes polihídricos xilitol HOCH2–(CHOH)3–CH2OH Y sorbitol СОН2– (СНН)4–СН2ОН Tienen un sabor dulce y se utilizan en lugar del azúcar en la elaboración de productos de repostería para diabéticos y personas que padecen obesidad. El sorbitol se encuentra en las bayas de serbal y cereza.
Preguntas: (para controlar el conocimiento)
- ¿Qué sustancias pertenecen a los alcoholes y cómo se forman los nombres de sus compuestos?
- ¿Qué tipos de isomería son característicos de los alcoholes? Dar ejemplos.
- ¿Mediante qué reacciones se pueden obtener los alcoholes?
- ¿Qué reacciones químicas son características de los alcoholes saturados? Dar ecuaciones de reacción.
- ¿Dónde se utilizan los alcoholes?
Lista de fuentes utilizadas.
Las bebidas embriagantes que contienen etanol, un alcohol vínico monohídrico, son familiares para la humanidad desde la antigüedad. Estaban elaborados con miel y frutas fermentadas. En la antigua China, el arroz también se añadía a las bebidas.
El alcohol del vino se obtenía en Oriente (siglos VI-VII). Los científicos europeos lo crearon a partir de productos de fermentación en el siglo XI. La corte real rusa la conoció en el siglo XIV: la embajada genovesa la presentó como agua viva (“aqua vita”).
AQUELLOS. Lovitz, un científico ruso del siglo XVIII, fue el primero en obtener experimentalmente alcohol etílico absoluto mediante destilación con potasa: carbonato de potasio. El químico sugirió utilizar carbón para limpiar.
Gracias a los logros científicos de los siglos XIX y XX. El uso global de alcoholes se hizo posible. Los científicos del pasado desarrollaron una teoría sobre la estructura de las soluciones hidroalcohólicas y estudiaron sus propiedades fisicoquímicas. Se descubrieron métodos de fermentación: flujo cíclico y continuo.
Inventos importantes de la ciencia química del pasado, que hicieron reales las propiedades beneficiosas de los alcoholes:
- Aparato de ratificación de Barbe (1881)
- Aparato de placa de destilación de Saval (1813)
- Caldera de Gentse (1873)
Se descubrió una serie homóloga de sustancias alcohólicas. Se llevaron a cabo una serie de experimentos sobre la síntesis de metanol y etilenglicol. La investigación científica avanzada en los años de la posguerra del siglo XX ayudó a mejorar la calidad de los productos. Hemos elevado el nivel de la industria alcohólica nacional.
Distribución en la naturaleza
En la naturaleza, los alcoholes se encuentran en forma libre. Las sustancias también son componentes de ésteres. El proceso de fermentación natural de los alimentos que contienen carbohidratos crea etanol, así como 1-butanol e isopropanol. Los alcoholes en la industria panadera, cervecera y vinícola están asociados con el uso del proceso de fermentación en estas industrias. La mayoría de las feromonas de insectos son alcoholes.
Derivados alcohólicos de los carbohidratos en la naturaleza:
- El sorbitol, que se encuentra en las bayas de serbal y cereza, tiene un sabor dulce.
Muchas sustancias aromáticas vegetales son alcoholes terpénicos:
- Fenhol: un componente de los frutos de hinojo, resinas de árboles coníferos.
- borneol: un elemento constituyente de la madera del árbol de borneoalcanfor
- El mentol es un componente de la composición de geranio y menta.
La bilis de humanos y animales contiene alcoholes polihídricos biliares:
- mixinol
- quimerol
- bufol
- colestanpentol
Efectos nocivos en el cuerpo.
El uso generalizado de alcoholes en la agricultura, la industria, los asuntos militares y el transporte los hace accesibles a los ciudadanos comunes. Esto provoca intoxicaciones agudas, incluso masivas, y muertes.
Los peligros del metanol
El metanol es un veneno peligroso. Tiene un efecto tóxico sobre el corazón y el sistema nervioso. La ingestión de 30 g de metanol provoca la muerte. La ingestión de una cantidad menor de la sustancia provoca una intoxicación grave con consecuencias irreversibles (ceguera).
Su concentración máxima permitida en el aire en el trabajo es de 5 mg/m³. Los líquidos que contienen incluso una cantidad mínima de metanol son peligrosos.
En formas leves de intoxicación, aparecen síntomas:
- escalofríos
- Debilidad general
- náuseas
- dolor de cabeza
El metanol no sabe ni huele diferente al etanol. Esto hace que el veneno se ingiera por error. ¿Cómo distinguir el etanol del metanol en casa?

El alambre de cobre se enrolla en espiral y se calienta fuertemente al fuego. Cuando interactúa con el etanol, se siente el olor a manzanas podridas. El contacto con metanol desencadenará una reacción de oxidación. Se liberará formaldehído, un gas con un olor acre desagradable.
Toxicidad del etanol
El etanol adquiere propiedades tóxicas y narcóticas según la dosis, la vía de entrada al organismo, la concentración y la duración de la exposición.
El etanol puede causar:
- alteración del sistema nervioso central
- cáncer de esófago, estómago
- gastritis
- cirrosis del higado
- enfermedades cardíacas
4-12 g de etanol por 1 kg de peso corporal es una dosis única letal. El acetaldehído, el principal metabolito del etanol, es una sustancia cancerígena, mutagénica y tóxica. Cambia las membranas celulares, las características estructurales de los glóbulos rojos y daña el ADN. El isopropanol es similar al etanol en cuanto a efectos tóxicos.
La producción de alcoholes y su circulación están reguladas por el Estado. El etanol no está legalmente reconocido como droga. Pero está demostrado su efecto tóxico en el organismo.
El efecto sobre el cerebro es especialmente destructivo. Su volumen disminuye. Se producen cambios orgánicos en las neuronas de la corteza cerebral, su daño y muerte. Se producen roturas capilares.
Se altera el funcionamiento normal del estómago, el hígado y los intestinos. El consumo excesivo de alcohol fuerte provoca dolor agudo y diarrea. La membrana mucosa del tracto gastrointestinal está dañada y la bilis se estanca.
Efectos de la inhalación de alcoholes.
El uso generalizado de alcoholes en muchas industrias crea la amenaza de sus efectos por inhalación. Los efectos tóxicos se estudiaron en ratas. Los resultados obtenidos se muestran en la tabla.
Industria de alimentos
El etanol es la base de las bebidas alcohólicas. Se obtiene de la remolacha azucarera, las patatas, las uvas, los cereales: centeno, trigo, cebada y otras materias primas que contienen azúcar o almidón. En el proceso de producción se utilizan tecnologías modernas para purificar aceites de fusel.
Se dividen en:
- fuerte con una proporción de etanol del 31-70% (coñac, absenta, ron, vodka)
- concentración media: del 9 al 30% de etanol (licores, vinos, licores)
- bajo contenido de alcohol: 1,5-8% (sidra, cerveza).
El etanol es la materia prima del vinagre natural. El producto se obtiene por oxidación con bacterias del ácido acético. La aireación (saturación forzada con aire) es una condición necesaria para el proceso.
El etanol no es el único alcohol presente en la industria alimentaria. La glicerina, aditivo alimentario E422, proporciona la conexión de líquidos inmiscibles. Se utiliza en la elaboración de repostería, pastas y productos de panadería. La glicerina es un componente de los licores que confiere a las bebidas viscosidad y sabor dulce.
El uso de glicerina tiene un efecto beneficioso sobre los productos:
- La pegajosidad de la pasta disminuye
- mejora la consistencia de dulces y cremas
- previene el rápido envejecimiento del pan y el hundimiento del chocolate
- Los productos se hornean sin que se pegue el almidón.
Es habitual el uso de alcoholes como edulcorantes. Para este fin son adecuados el manitol, el xilitol y el sorbitol.
Perfumes y cosméticos
El agua, el alcohol y la composición de perfume (concentrado) son los componentes principales de los productos de perfumería. Se utilizan en diferentes proporciones. La tabla presenta los tipos de perfumes y las proporciones de los componentes principales.
En la producción de productos de perfumería, el etanol altamente purificado actúa como disolvente de sustancias aromáticas. Al reaccionar con el agua se forman sales que precipitan. La solución reposa durante varios días y se filtra.
El 2-feniletanol sustituye al aceite de rosas natural en la industria de la perfumería y la cosmética. El líquido tiene un ligero aroma floral. Incluido en composiciones de fantasía y flores, leches cosméticas, cremas, elixires, lociones.
La base principal de muchos productos para el cuidado es la glicerina. Es capaz de atraer la humedad, hidratar activamente la piel y hacerla elástica. La piel seca y deshidratada se beneficia de las cremas, mascarillas y jabones con glicerina: crea una película que conserva la humedad en la superficie y mantiene la piel suave.
Existe un mito: que el uso de alcohol en cosméticos es perjudicial. Sin embargo, estos compuestos orgánicos son estabilizadores, portadores de sustancias activas y emulsionantes necesarios para la producción de productos.
Los alcoholes (especialmente los grasos) hacen que los productos para el cuidado sean cremosos y suavizan la piel y el cabello. El etanol presente en champús y acondicionadores hidrata, se evapora rápidamente después de lavarse el cabello y facilita el peinado y el peinado.
Medicamento
El etanol se utiliza en la práctica médica como antiséptico. Destruye los microbios, previene la descomposición en heridas abiertas y retrasa los cambios dolorosos en la sangre.
Sus propiedades secantes, desinfectantes y bronceadoras son la razón por la que el personal médico lo utiliza para tratar las manos antes de trabajar con un paciente. Durante la ventilación artificial, el etanol es indispensable como antiespumante. Si hay escasez de medicamentos, se convierte en un componente de la anestesia general.
En caso de intoxicación con etilenglicol o metanol, el etanol se convierte en un antídoto. Después de tomarlo, la concentración de sustancias tóxicas disminuye. El etanol se utiliza para calentar compresas y frotar para enfriar. La sustancia restaura el cuerpo durante el calor febril y los resfriados.
La ciencia de la farmacología estudia los alcoholes en los medicamentos y sus efectos en los seres humanos. El etanol como disolvente se utiliza en la producción de extractos y tinturas de materiales vegetales medicinales (espino, pimienta, ginseng, agripalma).

Estos medicamentos líquidos sólo deben tomarse tras consejo médico. ¡Debe seguir estrictamente la dosis prescrita por su médico!
Combustible
La disponibilidad comercial de metanol, butanol-1 y etanol es la razón de su uso como combustible. Mezclado con combustible diesel, gasolina, utilizado como combustible en su forma pura. Las mezclas ayudan a reducir la toxicidad de los gases de escape.
El alcohol, como fuente alternativa de combustible, tiene sus desventajas:
- Las sustancias tienen mayores características corrosivas, a diferencia de los hidrocarburos.
- Si entra humedad en el sistema de combustible, se producirá una fuerte disminución de la potencia debido a la solubilidad de las sustancias en el agua.
- Existe riesgo de obstrucciones de vapor y deterioro del rendimiento del motor debido a los bajos puntos de ebullición de las sustancias.
Sin embargo, los recursos de gas y petróleo son finitos. Por tanto, el uso de alcoholes en la práctica mundial se ha convertido en una alternativa al uso de combustible convencional. Su producción en masa se está instaurando a partir de residuos industriales (pulpa y papel, alimentos, carpintería), al mismo tiempo que se resuelve el problema del reciclaje.
El procesamiento industrial de materias primas vegetales permite obtener un biocombustible respetuoso con el medio ambiente: el bioetanol. Las materias primas para ello son el maíz (EE.UU.), la caña de azúcar (Brasil).
El balance energético positivo y el recurso de combustible renovable hacen de la producción de bioetanol un área popular de la economía global.
Solventes, tensioactivos
Además de en la producción de cosméticos, perfumes, medicamentos líquidos y productos de confitería, los alcoholes también son buenos disolventes:
Alcohol como disolvente:
- en la fabricación de superficies metálicas, elementos electrónicos, papel fotográfico, películas fotográficas.
- al limpiar productos naturales: resinas, aceites, ceras, grasas
- en el proceso de extracción - extraer una sustancia
- al crear materiales poliméricos sintéticos (pegamento, barniz), pinturas
- en la producción de aerosoles médicos y domésticos.
Los disolventes populares son el isopropanol, el etanol y el metanol. También se utilizan sustancias polihídricos y cíclicos: glicerina, ciclohexanol, etilenglicol.
Los tensioactivos se producen a partir de alcoholes grasos superiores. El cuidado completo de tu coche, vajilla, apartamento y ropa es posible gracias a los tensioactivos. Forman parte de productos de limpieza y detergentes y se utilizan en muchos sectores de la economía (ver tabla).
| Industria | Tensioactivos: funciones, propiedades. |
|---|---|
| Agricultura | Incluido en emulsiones; aumentar la productividad del proceso de transferencia de nutrientes a las plantas |
| Construcción | Reducir la demanda de agua para mezclas de hormigón y cemento; aumentar la resistencia a las heladas y la densidad de los materiales. |
| Industria del cuero | Evita que los productos se peguen y dañen. |
| Industria textil | Eliminar la electricidad estática |
| Metalurgia | Reducir la fricción; capaz de soportar altas temperaturas |
| Industria del papel | Separa la celulosa hervida de la tinta durante el proceso de reciclaje del papel usado. |
| Industria de la pintura | Permite la penetración completa de la pintura en las superficies, incluidos los pequeños huecos. |

El uso de alcoholes en la industria alimentaria, medicinal, en la producción de perfumes y cosméticos, como combustible, disolventes y tensioactivos tiene un efecto positivo en el estado de la economía del país. Aporta comodidad a la vida de una persona, pero requiere el cumplimiento de precauciones de seguridad debido a la toxicidad de las sustancias.
Estructura
Los alcoholes (o alcanoles) son sustancias orgánicas cuyas moléculas contienen uno o más grupos hidroxilo (grupos -OH) conectados a un radical hidrocarbonado.
Según la cantidad de grupos hidroxilo (atomicidad), los alcoholes se dividen en:
monoatómico
dihídrico (glicoles)
triatómico.
Por su naturaleza se distinguen los siguientes alcoholes:
Saturado, que contiene solo radicales hidrocarbonados saturados en la molécula.
insaturado, que contiene enlaces múltiples (dobles y triples) entre los átomos de carbono en la molécula
aromático, es decir alcoholes que contienen un anillo de benceno y un grupo hidroxilo en la molécula, conectados entre sí no directamente, sino a través de átomos de carbono.
Las sustancias orgánicas que contienen grupos hidroxilo en una molécula, conectados directamente al átomo de carbono del anillo de benceno, difieren significativamente en sus propiedades químicas de los alcoholes y, por lo tanto, se clasifican como una clase independiente de compuestos orgánicos: los fenoles. Por ejemplo, hidroxibenceno fenol. Más adelante aprenderemos más sobre la estructura, propiedades y uso de los fenoles.
También los hay poliatómicos (poliatómicos) que contienen más de tres grupos hidroxilo en la molécula. Por ejemplo, el alcohol hexahídrico más simple es el hexaol (sorbitol).
Cabe señalar que los alcoholes que contienen dos grupos hidroxilo en un átomo de carbono son inestables y se descomponen espontáneamente (sujetos a una reordenación de los átomos) para formar aldehídos y cetonas: 
Los alcoholes insaturados que contienen un grupo hidroxilo en un átomo de carbono conectado por un doble enlace se llaman ecoles. No es difícil adivinar que el nombre de esta clase de compuestos se forma a partir de los sufijos -en y -ol, lo que indica la presencia de un doble enlace y un grupo hidroxilo en las moléculas. Los enoles, por regla general, son inestables y se transforman (isomerizan) espontáneamente en compuestos carbonílicos: aldehídos y cetonas. Esta reacción es reversible, el proceso en sí se llama tautomerismo cetoenólico. Así, el enol más simple, el alcohol vinílico, se isomeriza extremadamente rápidamente en acetaldehído.
Según la naturaleza del átomo de carbono al que está unido el grupo hidroxilo, los alcoholes se dividen en:
Primario, en cuyas moléculas el grupo hidroxilo está unido al átomo de carbono primario.
secundario, en cuyas moléculas el grupo hidroxilo está unido a un átomo de carbono secundario
terciario, en cuyas moléculas el grupo hidroxilo está unido a un átomo de carbono terciario, por ejemplo:
Nomenclatura e isomería
Al nombrar alcoholes, se añade el sufijo (genérico) -ol al nombre del hidrocarburo correspondiente al alcohol. Los números después del sufijo indican la posición del grupo hidroxilo en la cadena principal, y los prefijos di-, tri-, tetra-, etc. indican su número: 
A partir del tercer miembro de la serie homóloga, los alcoholes presentan isomería de la posición del grupo funcional (propanol-1 y propanol-2), y a partir del cuarto, isomería del esqueleto carbonado (butanol-1; 2-metilpropanol-1). ). También se caracterizan por la isomería entre clases: los alcoholes son isómeros de los éteres.
Roda, que forma parte del grupo hidroxilo de las moléculas de alcohol, se diferencia marcadamente de los átomos de hidrógeno y carbono en su capacidad para atraer y retener pares de electrones. Debido a esto, las moléculas de alcohol contienen enlaces polares C-O y O-H.
Propiedades físicas de los alcoholes.
Dada la polaridad del enlace O-H y la importante carga positiva parcial localizada (centrada) en el átomo de hidrógeno, se dice que el hidrógeno del grupo hidroxilo es de naturaleza “ácida”. En esto se diferencia marcadamente de los átomos de hidrógeno que forman parte del radical hidrocarbonado.
Cabe señalar que el átomo de oxígeno del grupo hidroxilo tiene una carga negativa parcial y dos pares de electrones libres, lo que permite a los alcoholes formar enlaces de hidrógeno especiales entre moléculas. Los enlaces de hidrógeno se producen cuando un átomo de hidrógeno parcialmente cargado positivamente de una molécula de alcohol interactúa con un átomo de oxígeno parcialmente cargado negativamente de otra molécula. Es gracias a los enlaces de hidrógeno entre las moléculas que los alcoholes tienen puntos de ebullición anormalmente altos para su peso molecular. Así, el propano con un peso molecular relativo de 44 en condiciones normales es un gas, y el alcohol más simple es el metanol, que tiene un peso molecular relativo de 32, en condiciones normales es un líquido.
Los miembros inferiores y medios de una serie de alcoholes monohídricos saturados, que contienen de uno a once átomos de carbono, son líquidos. Los alcoholes superiores (a partir de C 12 H 25 OH) son sólidos a temperatura ambiente. Los alcoholes inferiores tienen un olor alcohólico característico y un sabor picante; son muy solubles en agua. A medida que aumenta el radical hidrocarbonado, la solubilidad de los alcoholes en agua disminuye y el octanol ya no se mezcla con el agua.
Propiedades químicas
Las propiedades de las sustancias orgánicas están determinadas por su composición y estructura. Los alcoholes confirman la regla general. Sus moléculas incluyen radicales hidrocarbonados e hidroxilo, por lo que las propiedades químicas de los alcoholes están determinadas por la interacción y la influencia de estos grupos entre sí. Las propiedades características de esta clase de compuestos se deben a la presencia de un grupo hidroxilo.
1. Interacción de alcoholes con metales alcalinos y alcalinotérreos. Para identificar el efecto de un radical hidrocarbonado sobre un grupo hidroxilo, es necesario comparar las propiedades de una sustancia que contiene un grupo hidroxilo y un radical hidrocarbonado, por un lado, y una sustancia que contiene un grupo hidroxilo y no contiene un radical hidrocarbonado. , en el otro. Tales sustancias pueden ser, por ejemplo, etanol (u otro alcohol) y agua. El hidrógeno del grupo hidroxilo de las moléculas de alcohol y de las moléculas de agua es capaz de ser reducido por metales alcalinos y alcalinotérreos (reemplazados por ellos).
Con el agua esta interacción es mucho más activa que con el alcohol, va acompañada de una gran liberación de calor y puede provocar una explosión. Esta diferencia se explica por las propiedades donadoras de electrones del radical más cercano al grupo hidroxilo. Al poseer las propiedades de un donante de electrones (efecto +I), el radical aumenta ligeramente la densidad electrónica en el átomo de oxígeno, lo "satura" por sí solo, reduciendo así la polaridad del enlace O-H y la naturaleza "ácida" de el átomo de hidrógeno del grupo hidroxilo en las moléculas de alcohol en comparación con las moléculas de agua.
2. Interacción de alcoholes con haluros de hidrógeno. La sustitución de un grupo hidroxilo por un halógeno conduce a la formación de haloalcanos.
Por ejemplo:
C2H5OH + HBr<->C2H5Br + H2O
Esta reacción es reversible.
3. Deshidratación intermolecular de alcoholes: la separación de una molécula de agua de dos moléculas de alcohol cuando se calienta en presencia de agentes eliminadores de agua.
Como resultado de la deshidratación intermolecular de alcoholes, se forman éteres. Así, cuando se calienta alcohol etílico con ácido sulfúrico a una temperatura de 100 a 140 ° C, se forma éter dietílico (azufre).
4. Interacción de alcoholes con ácidos orgánicos e inorgánicos para formar ésteres (reacción de esterificación):

La reacción de esterificación está catalizada por ácidos inorgánicos fuertes.
Por ejemplo, la interacción del alcohol etílico y el ácido acético produce acetato de etilo - acetato de etilo: 
5. La deshidratación intramolecular de alcoholes ocurre cuando los alcoholes se calientan en presencia de agentes de eliminación de agua a una temperatura más alta que la temperatura de deshidratación intermolecular. Como resultado, se forman alquenos. Esta reacción se debe a la presencia de un átomo de hidrógeno y un grupo hidroxilo en los átomos de carbono adyacentes. Un ejemplo es la reacción de producción de eteno (etileno) calentando etanol por encima de 140 °C en presencia de ácido sulfúrico concentrado.
6. La oxidación de los alcoholes suele realizarse con agentes oxidantes fuertes, como dicromato de potasio o permanganato de potasio, en un ambiente ácido. En este caso, la acción del agente oxidante se dirige al átomo de carbono que ya está unido al grupo hidroxilo. Dependiendo de la naturaleza del alcohol y de las condiciones de reacción, se pueden formar diversos productos. Así, los alcoholes primarios se oxidan primero a aldehídos y luego a ácidos carboxílicos: 
Los alcoholes terciarios son bastante resistentes a la oxidación. Sin embargo, en condiciones duras (agente oxidante fuerte, alta temperatura), es posible la oxidación de los alcoholes terciarios, lo que ocurre con la ruptura de los enlaces carbono-carbono más cercanos al grupo hidroxilo.
7. Deshidrogenación de alcoholes. Cuando se hace pasar vapor de alcohol a 200-300 °C sobre un catalizador metálico, como cobre, plata o platino, los alcoholes primarios se convierten en aldehídos y los alcoholes secundarios en cetonas:

La presencia de varios grupos hidroxilo en la molécula de alcohol al mismo tiempo determina las propiedades específicas de los alcoholes polihídricos, que son capaces de formar compuestos complejos de color azul brillante solubles en agua cuando interactúan con un precipitado de hidróxido de cobre (II) recién obtenido.
Los alcoholes monohídricos no pueden participar en esta reacción. Por tanto, se trata de una reacción cualitativa a alcoholes polihídricos.
Los alcoholatos de metales alcalinos y alcalinotérreos sufren hidrólisis al interactuar con el agua. Por ejemplo, cuando se disuelve etóxido de sodio en agua, se produce una reacción reversible.
C2H5ONa + HON<->C2H5OH + NaOH
cuyo equilibrio está casi completamente desplazado hacia la derecha. Esto también confirma que el agua es superior a los alcoholes en sus propiedades ácidas (la naturaleza "ácida" del hidrógeno en el grupo hidroxilo). Así, la interacción de alcoholatos con agua puede considerarse como la interacción de una sal de un ácido muy débil (en este caso, el alcohol que formó el alcoholato actúa como tal) con un ácido más fuerte (aquí el agua juega este papel).
Los alcoholes pueden exhibir propiedades básicas al reaccionar con ácidos fuertes, formando sales de alquiloxonio debido a la presencia de un par de electrones solitario en el átomo de oxígeno del grupo hidroxilo: 
La reacción de esterificación es reversible (la reacción inversa es la hidrólisis del éster), el equilibrio se desplaza hacia la derecha en presencia de agentes de eliminación de agua.
La deshidratación intramolecular de alcoholes se produce de acuerdo con la regla de Zaitsev: cuando se elimina agua de un alcohol secundario o terciario, se separa un átomo de hidrógeno del átomo de carbono menos hidrogenado. Por tanto, la deshidratación del 2-butanol da como resultado 2-buteno en lugar de 1-buteno.
La presencia de radicales hidrocarbonados en las moléculas de los alcoholes no puede dejar de afectar las propiedades químicas de los alcoholes.
Las propiedades químicas de los alcoholes provocadas por el radical hidrocarbonado son diferentes y dependen de su naturaleza. Entonces, todos los alcoholes arden; Los alcoholes insaturados que contienen un doble enlace C=C en la molécula entran en reacciones de adición, sufren hidrogenación, añaden hidrógeno, reaccionan con halógenos, por ejemplo, decoloran el agua con bromo, etc.
Métodos de obtención
1. Hidrólisis de haloalcanos. Ya sabes que la formación de haloalcanos cuando los alcoholes interactúan con los halógenos de hidrógeno es una reacción reversible. Por tanto, está claro que los alcoholes se pueden obtener mediante hidrólisis de haloalcanos, la reacción de estos compuestos con agua.
Los alcoholes polihídricos se pueden obtener mediante hidrólisis de haloalcanos que contienen más de un átomo de halógeno por molécula.
2. La hidratación de los alquenos (la adición de agua en el enlace tg de una molécula de alqueno) ya le resulta familiar. La hidratación del propeno conduce, según la regla de Markovnikov, a la formación de un alcohol secundario: propanol-2.
ÉL
yo
CH2=CH-CH3 + H20 -> CH3-CH-CH3
propeno propanol-2
3. Hidrogenación de aldehídos y cetonas. Ya sabes que la oxidación de los alcoholes en condiciones suaves conduce a la formación de aldehídos o cetonas. Es obvio que los alcoholes pueden obtenerse mediante hidrogenación (reducción con hidrógeno, adición de hidrógeno) de aldehídos y cetonas.
4. Oxidación de alquenos. Los glicoles, como ya se señaló, se pueden obtener oxidando alquenos con una solución acuosa de permanganato de potasio. Por ejemplo, el etilenglicol (etanodiol-1,2) se forma mediante la oxidación del etileno (eteno).
5. Métodos específicos de producción de alcoholes. Algunos alcoholes se obtienen mediante métodos que les son exclusivos. Así, el metanol se produce industrialmente mediante la interacción de hidrógeno con monóxido de carbono (II) (monóxido de carbono) a presión elevada y alta temperatura en la superficie de un catalizador (óxido de zinc).
La mezcla de monóxido de carbono e hidrógeno necesaria para esta reacción, también llamada (¡piense por qué!) “gas de síntesis”, se obtiene haciendo pasar vapor de agua sobre carbón caliente.
6. Fermentación de la glucosa. Este método de producción de alcohol etílico (vino) es conocido por el hombre desde la antigüedad.
Consideremos la reacción de producción de alcoholes a partir de haloalcanos: la reacción de hidrólisis de hidrocarburos halogenados. Suele realizarse en un ambiente alcalino. El ácido bromhídrico liberado se neutraliza y la reacción avanza casi hasta su finalización.
Esta reacción, como muchas otras, se produce mediante el mecanismo de sustitución nucleofílica.
Se trata de reacciones cuya etapa principal es la sustitución, que se produce bajo la influencia de una partícula nucleofílica.
Recordemos que una partícula nucleofílica es una molécula o ion que tiene un par de electrones solitario y es capaz de ser atraída por una "carga positiva", regiones de la molécula con una densidad electrónica reducida.
Las especies nucleofílicas más comunes son el amoníaco, el agua, el alcohol o los aniones (hidroxilo, haluro, ion alcóxido).
La partícula (átomo o grupo de átomos) que es reemplazada por una reacción con un nucleófilo se llama grupo saliente.
La sustitución del grupo hidroxilo de un alcohol por un ion haluro también se produce mediante el mecanismo de sustitución nucleofílica:
CH3CH2OH + HBr -> CH3CH2Br + H20
Curiosamente, esta reacción comienza con la adición de un catión de hidrógeno al átomo de oxígeno contenido en el grupo hidroxilo:
CH3CH2-OH + H+ -> CH3CH2-OH
Bajo la influencia de un ion cargado positivamente adjunto, el enlace C-O se desplaza aún más hacia el oxígeno y aumenta la carga positiva efectiva en el átomo de carbono.
Esto lleva al hecho de que la sustitución nucleófila con un ion haluro ocurre mucho más fácilmente y una molécula de agua se escinde bajo la acción de un nucleófilo.
CH3CH2-OH+ + Br -> CH3CH2Br + H2O
Preparación de éteres
Cuando el alcóxido de sodio reacciona con bromoetano, el átomo de bromo se reemplaza por un ion alcóxido y se forma un éter.
La reacción de sustitución nucleofílica en general se puede escribir de la siguiente manera:
R - X +HNu -> R - Nu +HX,
si la partícula nucleofílica es una molécula (HBr, H20, CH3CH2OH, NH3, CH3CH2NH2),
R-X + Nu - -> R-Nu + X - ,
si el nucleófilo es un anión (OH, Br-, CH3CH2O -), donde X es un halógeno, Nu es una partícula nucleófila.
Representantes individuales de alcoholes y su significado.
El metanol (alcohol metílico CH3OH) es un líquido incoloro con un olor característico y un punto de ebullición de 64,7 °C. Arde con una llama ligeramente azulada. El nombre histórico del metanol, alcohol de madera, se explica por uno de los métodos de producción: la destilación de madera dura (en griego, vino, emborracharse; sustancia, madera).
¡El metanol es muy venenoso! Requiere un manejo cuidadoso al trabajar con él. Bajo la acción de la enzima alcohol deshidrogenasa, se convierte en el cuerpo en formaldehído y ácido fórmico, que dañan la retina, provocan la muerte del nervio óptico y la pérdida total de la visión. La ingestión de más de 50 ml de metanol provoca la muerte.
El etanol (alcohol etílico C2H5OH) es un líquido incoloro con un olor característico y un punto de ebullición de 78,3 °C. Inflamable Se mezcla con agua en cualquier proporción. La concentración (concentración) del alcohol generalmente se expresa como porcentaje en volumen. El alcohol "puro" (medicinal) es un producto obtenido a partir de materias primas alimentarias y que contiene 96% (en volumen) de etanol y 4% (en volumen) de agua. Para obtener etanol anhidro, "alcohol absoluto", este producto se trata con sustancias que se unen químicamente al agua (óxido de calcio, sulfato de cobre (II) anhidro, etc.).
Para que el alcohol utilizado con fines técnicos no sea apto para beber, se le añaden y tiñen pequeñas cantidades de sustancias tóxicas, de mal olor y de sabor desagradables, difíciles de separar. El alcohol que contiene tales aditivos se llama alcohol desnaturalizado o desnaturalizado.

El etanol se usa ampliamente en la industria para la producción de caucho sintético, medicamentos, se usa como solvente, forma parte de barnices, pinturas y perfumes. En medicina, el alcohol etílico es el desinfectante más importante. Utilizado para preparar bebidas alcohólicas.
Cuando pequeñas cantidades de alcohol etílico ingresan al cuerpo humano, reducen la sensibilidad al dolor y bloquean los procesos de inhibición en la corteza cerebral, provocando un estado de intoxicación. En esta etapa de acción del etanol, aumenta la separación de agua en las células y, en consecuencia, se acelera la formación de orina, lo que resulta en la deshidratación del cuerpo.
Además, el etanol provoca la dilatación de los vasos sanguíneos. El aumento del flujo sanguíneo en los capilares de la piel provoca enrojecimiento de la piel y una sensación de calor.
En grandes cantidades, el etanol inhibe la actividad cerebral (etapa de inhibición) y provoca una alteración de la coordinación de los movimientos. Un producto intermedio de la oxidación del etanol en el organismo, el acetaldehído, es extremadamente tóxico y provoca intoxicaciones graves.
El consumo sistemático de alcohol etílico y bebidas que lo contienen provoca una disminución persistente de la productividad cerebral, la muerte de las células hepáticas y su sustitución por tejido conectivo: cirrosis hepática.
El etanodiol-1,2 (etilenglicol) es un líquido viscoso incoloro. Venenoso. Ilimitadamente soluble en agua. Las soluciones acuosas no cristalizan a temperaturas muy por debajo de 0 °C, lo que permite utilizarlas como componente de refrigerantes no congelantes: anticongelantes para motores de combustión interna.
El propanetriol-1,2,3 (glicerol) es un líquido viscoso y almibarado con un sabor dulce. Ilimitadamente soluble en agua. No volátil. Como componente de los ésteres, se encuentra en grasas y aceites. Ampliamente utilizado en las industrias cosmética, farmacéutica y alimentaria. En cosmética, la glicerina desempeña el papel de agente emoliente y calmante. Se añade a la pasta de dientes para evitar que se seque. Se añade glicerina a los productos de confitería para evitar su cristalización. Se pulveriza sobre el tabaco, en cuyo caso actúa como humectante que evita que las hojas de tabaco se sequen y se desmoronen antes de procesarlas. Se añade a los adhesivos para evitar que se sequen demasiado rápido y a los plásticos, especialmente al celofán. En este último caso, la glicerina actúa como plastificante, actuando como un lubricante entre las moléculas de polímero y dando así a los plásticos la flexibilidad y elasticidad necesarias.
1. ¿Qué sustancias se llaman alcoholes? ¿Con qué criterios se clasifican los alcoholes? ¿Qué alcoholes deberían clasificarse como butanol-2? buteno-Z-ol-1? penten-4-diol-1,2?
2. Escriba las fórmulas estructurales de los alcoholes enumerados en el ejercicio 1.
3. ¿Existen alcoholes cuaternarios? Explica tu respuesta.
4. ¿Cuántos alcoholes tienen la fórmula molecular C5H120? Inventa las fórmulas estructurales de estas sustancias y nómbralas. ¿Esta fórmula puede corresponder sólo a alcoholes? Inventa las fórmulas estructurales de dos sustancias que tengan la fórmula C5H120 y no sean alcoholes.
5. Nombra las sustancias cuyas fórmulas estructurales se dan a continuación: 
6. Escribe las fórmulas estructurales y empíricas de una sustancia cuyo nombre es 5-metil-4-hexen-1-inol-3. Compare el número de átomos de hidrógeno en la molécula de este alcohol con el número de átomos de hidrógeno en la molécula de un alcano con el mismo número de átomos de carbono. ¿Qué explica esta diferencia?
7. Comparando la electronegatividad del carbono y el hidrógeno, explique por qué el enlace covalente O-H es más polar que el enlace C-O.
8. ¿Qué alcohol crees que (metanol o 2-metilpropanol-2) reaccionará más activamente con el sodio? Explica tu respuesta. Escriba las ecuaciones para las reacciones correspondientes.
9. Escriba las ecuaciones de reacción para la interacción del 2-propanol (alcohol isopropílico) con sodio y bromuro de hidrógeno. Nombra los productos de reacción e indica las condiciones para su implementación.
10. Se pasó una mezcla de vapores de propanol-1 y propanol-2 sobre óxido de cobre (P) calentado. ¿Qué reacciones podrían ocurrir en este caso? Escriba las ecuaciones para estas reacciones. ¿A qué clases de compuestos orgánicos pertenecen sus productos?
11. ¿Qué productos se pueden formar durante la hidrólisis del 1,2-dicloropropanol? Escriba las ecuaciones para las reacciones correspondientes. Nombra los productos de estas reacciones.
12. Escriba las ecuaciones de las reacciones de hidrogenación, hidratación, halogenación e hidrohalogenación del 2-propenol-1. Nombra los productos de todas las reacciones.
13. Escriba las ecuaciones para la interacción del glicerol con uno, dos y tres moles de ácido acético. Escriba la ecuación para la hidrólisis de un éster: el producto de la esterificación de un mol de glicerol y tres moles de ácido acético.
14*. Cuando el alcohol monohídrico saturado primario reaccionó con sodio, se liberaron 8,96 litros de gas (n.e.). Cuando se deshidrata la misma masa de alcohol, se forma un alqueno que pesa 56 g. Determine todas las fórmulas estructurales posibles del alcohol.
15*. El volumen de dióxido de carbono liberado durante la combustión de alcohol monohídrico saturado es 8 veces mayor que el volumen de hidrógeno liberado por la acción del exceso de sodio sobre la misma cantidad de alcohol. Establecer la estructura de un alcohol si se sabe que su oxidación produce una cetona.
uso de alcoholes
Dado que los alcoholes tienen diversas propiedades, su campo de aplicación es bastante amplio. Intentemos averiguar dónde se utilizan los alcoholes.

Alcoholes en la industria alimentaria.
El alcohol como el etanol es la base de todas las bebidas alcohólicas. Y se obtiene a partir de materias primas que contienen azúcar y almidón. Estas materias primas pueden ser remolachas azucareras, patatas, uvas y diversos cereales. Gracias a las tecnologías modernas, durante la producción de alcohol, se purifica a partir de aceites de fusel.
El vinagre natural también contiene materias primas a base de etanol. Este producto se obtiene mediante oxidación por bacterias del ácido acético y aireación.
Pero en la industria alimentaria no sólo se utiliza etanol, sino también glicerina. Este aditivo alimentario favorece la conexión de líquidos inmiscibles. La glicerina, que forma parte de los licores, puede darles viscosidad y un sabor dulce.
Además, la glicerina se utiliza en la fabricación de productos de panadería, pasta y repostería.
Medicamento
En medicina, el etanol es simplemente insustituible. En esta industria, se usa ampliamente como antiséptico, ya que tiene propiedades que pueden destruir microbios, retrasar cambios dolorosos en la sangre y prevenir la descomposición en heridas abiertas.
Los trabajadores médicos utilizan etanol antes de realizar diversos procedimientos. Este alcohol tiene propiedades desinfectantes y secantes. Durante la ventilación artificial de los pulmones, el etanol actúa como antiespumante. El etanol también puede ser uno de los componentes de la anestesia.
Cuando está resfriado, el etanol se puede utilizar como compresa caliente y, cuando se está enfriando, como agente para frotar, ya que sus sustancias ayudan a restaurar el cuerpo durante el calor y los escalofríos.
En caso de intoxicación con etilenglicol o metanol, el uso de etanol ayuda a reducir la concentración de sustancias tóxicas y actúa como antídoto.
Los alcoholes también juegan un papel muy importante en la farmacología, ya que se utilizan para preparar tinturas curativas y todo tipo de extractos.
Alcoholes en cosmética y perfumes.

En perfumería, también es imposible prescindir del alcohol, ya que la base de casi todos los productos de perfumería es el agua, el alcohol y el concentrado de perfume. El etanol en este caso actúa como disolvente de sustancias aromáticas. Pero el 2-feniletanol tiene un aroma floral y puede sustituir al aceite de rosas natural en perfumería. Se utiliza en la fabricación de lociones, cremas, etc.
La glicerina también es la base de muchos cosméticos, ya que tiene la capacidad de atraer la humedad e hidratar activamente la piel. Y la presencia de etanol en champús y acondicionadores ayuda a hidratar la piel y facilita el peinado después de lavarlo.
Combustible

Bueno, las sustancias que contienen alcohol como el metanol, el etanol y el butanol-1 se utilizan ampliamente como combustible.
Gracias al procesamiento de materiales vegetales como la caña de azúcar y el maíz, se logró obtener bioetanol, que es un biocombustible amigable con el medio ambiente.
Recientemente, la producción de bioetanol se ha vuelto popular en el mundo. Con su ayuda, apareció la perspectiva de renovar los recursos de combustible.
Solventes, tensioactivos
Además de las aplicaciones de los alcoholes ya enumeradas, cabe señalar que también son buenos disolventes. Los más populares en esta área son el isopropanol, el etanol y el metanol. También se utilizan en la producción de productos químicos para bits. Sin ellos no es posible el cuidado adecuado del coche, la ropa, los utensilios del hogar, etc.
El uso de alcohol en diversas áreas de nuestras actividades tiene un efecto positivo en nuestra economía y aporta comodidad a nuestras vidas.